Negli ultimi anni si sente sempre più spesso parlare di microbiota e microbioma ed il loro coinvolgimento in tantissime malattie.
Ma in cosa consiste questo MICROBIOTA UMANO? Cos'è?
È l’insieme dei microorganismi che vivono in un ambiente ed a tutti sarà più nota come flora intestinale.
Ma in cosa consiste questo MICROBIOTA UMANO? Cos'è?
È l’insieme dei microorganismi che vivono in un ambiente ed a tutti sarà più nota come flora intestinale.
Utilizzare il termine flora intestinale è però ormai considerato scorretto in quanto questi microrganismi sono prevalentemente batteri e il termine flora evoca invece il regno vegetale.
Anche il termine umano è preferibile a intestinale per descrivere più fedelmente la natura simbiontica del microbiota.
L’insieme delle interazioni tra questi microorganismi (tramite il loro patrimonio genetico) e il nostro corpo (che sarà il loro ambiente) è detto MICROBIOMA.
Per ogni cellula del nostro corpo, ce ne sono altre 10 di batteri e nel complesso il nostro corpo è fatto per il 10% da cellule umane e per il 90% da batteri. Ci potrebbe quasi far venire una crisi esistenziale!
Ognuno di noi ha 100 trilioni di batteri con cui convive, dentro il nostro corpo e fuori sulla nostra pelle. Ogni essere umano ha la sua collezione personale di batteri. Si potrebbero persino prendere impronte digitali batteriche. Se invece volessimo analizzare i germi di un cane, probabilmente potremmo risalire al suo padrone. Lo stesso vale per le tastiere dei computer. Tutto quello che tocchiamo spesso reca la nostra firma batterica.
Anche il termine umano è preferibile a intestinale per descrivere più fedelmente la natura simbiontica del microbiota.
L’insieme delle interazioni tra questi microorganismi (tramite il loro patrimonio genetico) e il nostro corpo (che sarà il loro ambiente) è detto MICROBIOMA.
Per ogni cellula del nostro corpo, ce ne sono altre 10 di batteri e nel complesso il nostro corpo è fatto per il 10% da cellule umane e per il 90% da batteri. Ci potrebbe quasi far venire una crisi esistenziale!
Ognuno di noi ha 100 trilioni di batteri con cui convive, dentro il nostro corpo e fuori sulla nostra pelle. Ogni essere umano ha la sua collezione personale di batteri. Si potrebbero persino prendere impronte digitali batteriche. Se invece volessimo analizzare i germi di un cane, probabilmente potremmo risalire al suo padrone. Lo stesso vale per le tastiere dei computer. Tutto quello che tocchiamo spesso reca la nostra firma batterica.
Questi microorganismi hanno un loro patrimonio genetico
che gli permette di vivere. Questo stesso patrimonio genetico, nei
microrganismi intestinali, influenza tantissimi processi del nostro
corpo come la digestione, le difese immunitarie, la fame e l’appetito e secernono sostanze perfino quando siamo sotto stress.
L’habitat intestinale umano contiene almeno 500-1.000 specie differenti di batteri, con ampia variabilità inter-individuale. In ogni caso, però, la maggior parte del microbiota intestinale è composta di anaerobi obbligati che superano per numerosità gli anaerobi e gli aerobi facoltativi di 2-3 ordini di grandezza. Sebbene a oggi siano stati descritti oltre 50 filum batterici, nel tratto gastrointestinale (GI) soltanto due sono quelli prevalenti: i Bacteroides (Gram negativi) e i Firmicutes (Gram positivi), mentre Proteobacteria, Verrucomicrobia, Actinobacteria, Fusobatteria e Cyanobacteria sono presenti in proporzioni assai minori.
Firmicutes è il filum batterico più numeroso e raggruppa più di 200 generi, compresi Lactobacillus, Mycoplasma, Bacillus e Clostridium, assai comuni nel microbiota intestinale.
Il numero delle cellule batteriche presenti nel tratto GI di un mammifero mostra un continuum crescente in senso oro-aborale (dalla bocca all’ano), variando da 103 batteri/g nello stomaco e duodeno, a 104-107 nel digiuno e nell’ileo, fino a oltre 1012 cellule/g nel cieco e colon.
L’habitat intestinale umano contiene almeno 500-1.000 specie differenti di batteri, con ampia variabilità inter-individuale. In ogni caso, però, la maggior parte del microbiota intestinale è composta di anaerobi obbligati che superano per numerosità gli anaerobi e gli aerobi facoltativi di 2-3 ordini di grandezza. Sebbene a oggi siano stati descritti oltre 50 filum batterici, nel tratto gastrointestinale (GI) soltanto due sono quelli prevalenti: i Bacteroides (Gram negativi) e i Firmicutes (Gram positivi), mentre Proteobacteria, Verrucomicrobia, Actinobacteria, Fusobatteria e Cyanobacteria sono presenti in proporzioni assai minori.
Firmicutes è il filum batterico più numeroso e raggruppa più di 200 generi, compresi Lactobacillus, Mycoplasma, Bacillus e Clostridium, assai comuni nel microbiota intestinale.
Il numero delle cellule batteriche presenti nel tratto GI di un mammifero mostra un continuum crescente in senso oro-aborale (dalla bocca all’ano), variando da 103 batteri/g nello stomaco e duodeno, a 104-107 nel digiuno e nell’ileo, fino a oltre 1012 cellule/g nel cieco e colon.
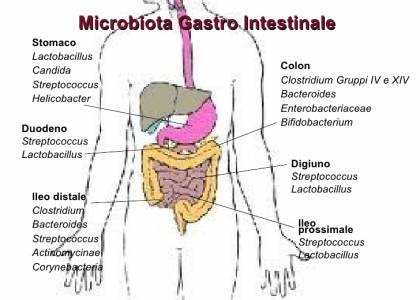
Nello stomaco la concentrazione batterica è bassa perché l’ambiente acido distrugge quasi tutti batteri che lo attraversano, agendo così come prima barriera difensiva verso la contaminazione dall’esterno. La maggior parte dei batteri risiede nella parte inferiore dell’apparato digerente, specialmente nell’intestino crasso, poiché nel tratto più prossimale anche la bile e le secrezioni pancreatiche risultano tossiche o poco favorevoli per la crescita della maggior parte dei microrganismi.
Il microbiota si inizia a formare subito dopo la nascita: i padri fondatori (passatemi il termine) della prima colonia batterica sono perlopiù germi vaginali e intestinali della madre, oltre a germi della pelle e magari anche quel che ha da offrire l’ospedale. Questi batteri colonizzano assai rapidamente il tratto GI del neonato inziando ad “addestrare” il suo sistema immunitario. Nonostante alcuni batteri ci mettano solo 20 minuti a fondare la generazione successiva, dovranno passare circa 3-4 fondamentali anni prima che nell’intestino si sia formata una flora adeguata. Durante questi anni è importantissima l’alimentazione del bambino.
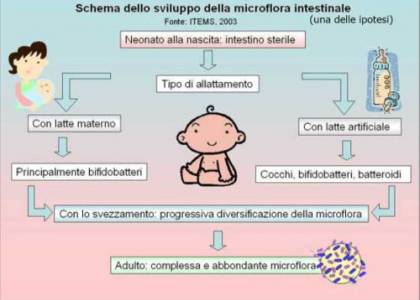
Il latte materno trasmette particolari batteri come i bifidobatteri che aiutano a plasmare le future funzioni dell’organismo, come il suo sistema immunitario e il metabolismo. Un bambino nel primo anno di vita munito di pochi bifidobatteri nell’intestino ha più probabilità di sviluppare sovrappeso in seguito nella vita, rispetto a un coetaneo che ne è ben fornito.
Esiste un equilibrio complesso e assai variabile fra i diversi microrganismi che risiedono normalmente nel tratto GI, dove svolgono un ruolo unitario ed essenziale per il mantenimento dell’omeostasi, per lo svolgimento dei processi digestivi e metabolici e per la regolazione del sistema immunitario locale dell’organismo ospite.
Anche se alcune specie batteriche nel microbiota possono essere agenti patogeni facoltativi, l’interazione costante fra l’ospite (noi) e i microbi residenti risulta solitamente favorevole alla salute dell’ospite, con un equilibrio fra le specie batteriche che favorisce i simbionti non patogeni.
La maggior parte della ricerca sul microbiota umano si focalizza sui microrganismi nell’intestino, poiché si pensa che influenzino la salute in vari modi. E’ stato documentato che le persone che soffrono di alcune malattie (ad esempio malattia infiammatoria intestinale, malattia dell’intestino irritabile, e diverse allergie) hanno un microbiota differente da quello delle persone sane, sebbene in molti casi sia impossibile dire se il microbiota alterato sia una causa o una conseguenza della malattia.
La composizione del microbiota intestinale è altamente variabile anche tra i soggetti sani. I ricercatori hanno scoperto che anche se la composizione varia tra gli individui, composizioni differenti possono avere funzioni simili (ad esempio come i microrganismi degradano certi composti nella dieta o come influenzano il sistema immunitario del corpo).
I microrganismi presenti nell’intestino giocano un ruolo cruciale per una digestione sana, ma influenzano anche il sistema immunitario. I tessuti immunitari nel tratto gastroenterico costituiscono la frazione più ampia e complessa del sistema immunitario umano. La mucosa intestinale è una superficie ampia che riveste l’intestino ed è esposta ad antigeni ambientali patogeni (che causano malattia) e non patogeni (sostanze che stimolano il sistema immunitario a produrre anticorpi). Nel lume intestinale, i microrganismi hanno un ruolo fondamentale nello sviluppo di un sistema immunitario forte e bilanciato. Le alterazioni nel microbiota intestinale di un individuo, che possono avvenire ad esempio quando si prendono certi antibiotici, possono aumentare il rischio di infezioni da patogeni opportunisti come il Clostridium difficile.
Di recente, i ricercatori hanno stabilito un legame tra il microbiota intestinale e il peso corporeo.
Sebbene molta della ricerca sia ancora agli inizi, è stato osservato che i microrganismi che colonizzano il tratto gastroenterico non sono solo ospiti quasi inerti ma sono attivi protagonisti di vivaci interazioni tra il tratto gastroenterico e il sistema neuro-immuno-endocrino e che le persone obese tendono ad avere una composizione diversa dei batteri intestinali paragonati ad individui magri.
Se la composizione alterata del microbiota sia una causa o una conseguenza dell’obesità è al momento sconosciuto. Gli studi mostrano che la composizione del microbiota intestinale si modifica con la perdita di peso e/o con l’aumento di peso.
Alcuni ricercatori hanno suggerito che il microbiota delle persone obese possa aiutare il corpo ad aumentare la quantità di energia che viene ricavata dall’alimento, suggerendo che certe strutture del microbiota intestinale possono aumentare la probabilità di diventare obesi.
Studi effettuati sia nel topo che nell’uomo hanno evidenziato una modificazione nella composizione del microbiota intestinale nei soggetti obesi con un incremento dei Firmicutes e una riduzione dei Bacteroidetes. Il microbiota può incidere sull’equilibrio nutrizionale e metabolico dell’organismo modulando la capacità di estrarre energia dagli alimenti della dieta e interagendo con il metabolismo glicolipidico. I metaboliti rilasciati dalla fermentazione di polisaccaridi complessi della dieta possono aumentare l’assorbimento di glucosio, stimolare la lipogenesi (“produzione del grasso”), modificare la composizione in acidi grassi del tessuto adiposo e del fegato, alterare la permeabilità della barriera mucosa intestinale, alterare la risposta immunitaria, contribuire ad uno stato di infiammazione cronica sistemica e allo stato di insulino-resistenza correlato all’obesità.
Cosa fare per accudire al meglio i nostri inquilini?
I probiotici sono definiti organismi vivi che, se somministrati in maniera adeguata, possono conferire benefici alla salute. Sono stati studiati numerosi tipi di probiotici. Si è evidenziato che alcuni tipi di probiotici sono efficaci per il miglioramento della sindrome dell’intestino irritabile, della colite ulcerosa (una forma di disturbo intestinale) e malattie infettive, così come possono ridurre il rischio di sviluppo di eczema e altre condizioni allergiche.
Anche gli individui sani possono trarre beneficio dall’assunzione dei probiotici. E’ stato dimostrato che i probiotici possono ridurre i rischi di malattie infettive, tra cui malattie del tratto respiratorio superiore di popolazioni sane. Ogni effetto del probiotico è generalmente specifico del ceppo di batterio probiotico usato. Questo indica che se viene individuato un effetto di un tipo di probiotico, non si possono trarre conclusioni sui possibili effetti di altri ceppi di probiotici.
Sebbene rimanga poco chiaro come i probiotici agiscano sulla salute, è stato suggerito che i probiotici potrebbero avere il potenziale di influenzare l’attività, piuttosto che la composizione, del microbiota. Se questo è il caso, consumare probiotici potrebbe avere effetto sulla salute anche quando non c’è cambiamento nella composizione del microbiota intestinale.
I prebiotici, invece, sono componenti alimentari non digeribili che vengono usati selettivamente dai batteri intestinali per la fermentazione. Questo implica che i batteri associati a effetti benefici per la salute possono essere ottenuti in modo specifico. Vi sono dati probanti che i prebiotici possono indurre cambiamenti nel microbiota intestinale ma non è ancora chiaro esattamente come l’uso di prebiotici possa alterare la composizione e la funzione del microbiota intestinale, quanto questi cambiamenti siano stabili e cosa ogni cambiamento nel microbiota significhi per la salute umana.
Prendere antibiotici può portare a disturbi del microbiota intestinale. Questo avviene a causa del loro effetto differenziale sui diversi tipi di batteri nell’intestino; batteri specifici sono particolarmente sensibili, o resistenti all’antibiotico in questione. Questo può portare a diarrea associata ad antibiotici e nell’ambiente ospedaliero può aumentare il rischio di una forma più grave di diarrea causata dal patogeno Clostridium difficile. L’impatto degli antibiotici è solitamente a breve termine, ma sono stati documentati ugualmente disturbi del microbiota intestinale per lunghi periodi di tempo. Vi è la prova che prendere i probiotici durante il trattamento con gli antibiotici può ridurre il rischio di sviluppare diarree associate agli antibiotici.
I microrganismi presenti nell’intestino umano sono quindi cruciali per la nostra salute e dobbiamo averne cura: sono parte di noi.
Se volete approfondire l'argomento senza entrare troppo nello scientifico, anzi divertendovi, vi consiglio di leggere "L'intestino felice" di Giulia Enders e di vedere anche questo breve e simpatico video sottotitolato in italiano.
Bibliografia
1. Wu GD & Lewis JD (2013). Analysis of the human gut microbiome and association with disease. Clinical Gastroenterology Hepatology 11(7):774-777.
2. Tremaroli V & Bäckhed F (2012). Functional interactions between the gut microbiota and host metabolism. Nature 489:242-249.
3. Robles Alonso V & Guarner F (2013). Linking the gut microbiota to human health. British Journal of Nutrition 109:S21-S26.
4. Torsten P.M. Scheithaurer, Geesje M, et al. (2016). Casuality of small and large intestinal microbiota in wheight regulation and insulin resistance.
5. Molinaro, Paschetta E, Cassader M, et al. (2012). Probiotics, prebiotics, energy balance, and obesity – mechanistic insights and therapeutic implications. Gastroenterology Clinics of North America 41(4):843-854.
6. Clarke SF, Murphy EF, Nilaweera K, et al. (2012). The gut microbiota and its relationship to diet and obesity. Gut Microbes 3(3):186-202.
7. Sanders ME, Guarner F, Guerrant R, et al. (2013). An update on the use and investigation of probiotics in health and disease. Gut 62(5):787-796.

